Rola cynku w ochronie przeciwkorozyjnej stali – przegląd zastosowań
Rodzaje powłok cynkowych na stali – sposoby wytwarzania
Wyróżnia się następujące powłoki cynkowe, w zależności od sposobu ich wytwarzania:
- cynkowanie proszkowe – utrzymanie przedmiotu przez kilka godzin w podwyższonej temperaturze (350-400°C) w sproszkowanym cynku zawierającym ok. 6% tlenku cynku;
- cynkowanie zanurzeniowe, metalizacja zanurzeniowa (cynkowanie ogniowe) – zanurzenie przedmiotu w ciekłej kąpieli cynkowej w odpowiednich wannach; technologia ta jest najbardziej rozpowszechniona i wykorzystywana przede wszystkim do powlekania stalowych blach warstwą cynku przeznaczonych do eksploatacji bezpośrednio w warunkach atmosferycznych lub po uprzednim dodatkowym zabezpieczeniu powierzchni powłokami malarskimi;
- cynkowanie natryskowe, metalizacja natryskowa – ciągły natrysk za pomocą odpowiedniego pistoletu stopionego w nim drutu na powierzchnię stalową (może być to urządzenie przewoźne);
- cynkowanie galwaniczne – nakładanie w procesie galwanicznym powłoki cynkowej, zazwyczaj małych elementów stalowych, często śrub, nakrętek itp. elementów.
Pył cynkowy
Stosowane są także powłoki organiczne pigmentowane pyłem cynkowym. Jego ilość w farbie powinna być na tyle duża, aby zachowane zostało przewodnictwo elektryczne pomiędzy zastosowanymi drobinkami cynku. Zawierać ona powinna 96% zmikronizowanego cynku w suchej powłoce.
Bardziej szczegółowe informacje dotyczące technologii nakładania powłok cynkowych na konstrukcje stalowe i opisujące rolę cynku w ochronie przed korozją stali znajdują się w opublikowanych w periodyku „STAL Metale & Nowe Technologie” opracowaniach P. Milewskiego [2-4] oraz A. Dulęby [5, 6].
Ochrona katodowa – cynk jako anoda galwaniczna
„Ojciec” ochrony katodowej, Sir Humphry Davy, w 1824 roku w Anglii zastosował anody żelazne (gwoździe) do ochrony przed korozją miedzianych blach poszycia kadłubów okrętów wojennych floty brytyjskiej. Pokrywający się w wodzie morskiej niebieskimi produktami korozji miedziany kadłub okrętu wskutek tego zabiegu przestał ulegać korozji. Blachy nabrały koloru czystej miedzi. Było to ewidentne potwierdzenie elektrochemicznego działania ochrony katodowej, a jej skuteczność łatwo można było ocenić wizualnie. I to nie tylko dlatego, że na kadłubie nie było produktów korozji. Także z powodu pojawienia się na nim nieobserwowanego dotychczas życia biologicznego i porastania kadłuba roślinnością morską. Nade wszystko jednak, utratą zdolności bojowej okrętów. Eksperyment ten potwierdził jednocześnie biobójcze właściwości jonów miedzi oraz podstawy teoretyczne ochrony katodowej – techniki ochrony przed korozją metalu w środowisku elektrolitycznym (przewodzącym prąd elektryczny – np. wodzie morskiej) poprzez połączenie elektryczne z metalem mniej szlachetnym, w tym przypadku żelazem, na którym wymuszone zostały przyspieszone reakcje utleniania.
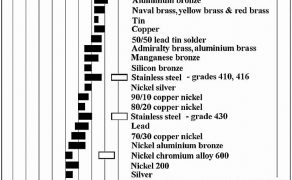
Zastosowanie cynku w charakterze anody galwanicznej do wywołania efektu ochrony katodowej zostało wykorzystane w gospodarce morskiej. Służyło do zabezpieczenia przed korozją w słonej wodzie morskiej stalowych kadłubów jednostek pływających, zbiorników balastowych na statkach, nabrzeży stalowych w portach (ścianek Larsena), a także magistralnych rurociągów podwodnych (fot. 1- 3).
Wydana w 2013 roku norma europejska dotycząca cynkowych anod galwanicznych [7] podaje następujące wymagania techniczne (do zastosowań morskich – typoszereg I):
Właściwości elektrochemiczne:
- wydajność prądowa w wodzie (inaczej: pojemność elektrochemiczna): minimum 800 Ah/kg,
- wydajność prądowa w mule morskim: minimum 750 Ah/kg,
- potencjał podczas pracy w wodzie (closed circuit potential): ≤ -1050 mV względem elektrody Ag/AgC l,
- potencjał podczas pracy w mule morskim (closed circuit potential): ≤ -990 mV względem Ag/AgCl.
Typoszereg II opiuje następujące własciwości – stopy wysokiej czystości cynku (min. 99,99%), do zastosowań w wodzie morskiej oraz w wodzie słodkiej. One cechują się nieco mniejszą wydajnością prądową oraz nieco bardziej dodatnim potencjałem podczas pracy w porównaniu do anod z większą ilością dodatków stopowych. Stop może zawierać następujące zanieczyszczenia: Al – maks. 0,05%, Cd – maks. 0,003%, Pb – maks. 0,003%, Cu – maks. 0,002%, Fe – maks. 0,0014%, pozostałe – maks. 0,05%. Wydajność prądowa: min. 760 Ah/kg, potencjał pracy w wodzie ≤ -1000 mV względem Ag/AgCl.

Ochrona katodowa – cynk jako elektroda pomiarowa
Urządzenia ochrony katodowej zabezpieczające przed korozją stalowe obiekty zarówno w wodzie morskiej, jak i w ziemi muszą zapewniać kontrolowany dopływ prądu ochronnego do zabezpieczanej powierzchni. Natężenie tego prądu powinno być regulowane ręcznie lub automatycznie, w zależności od wielkości polaryzacji chronionej powierzchni zmierzonej względem elektrody odniesienia. W warunkach morskich, a także i w ziemi, stosuje się do tego celu cynkową elektrodę odniesienia. Do pomiarów potencjałów w ziemi elektroda musi być umieszczona w specjalnym aktywatorze (fot. 3), zaś do pomiarów w wodzie morskiej powinna mieć bezpośredni kontakt z elektrolitem (fot. 4). Do bardziej wymagających pomiarów wykorzystuje się elektrody specjalnej konstrukcji, która umożliwia ocenę stanu technicznego roboczej jej części – cynku (fot. 5).

Elektroda cynkowa może być także wykorzystywana do pomiarów spadków napięć w ziemi. Przeprowadza się je m.in. w celu oceny zagrożenia korozyjnego prądami błądzącymi trakcji elektrycznych. Taki rodzaj elektrod cynkowych, podczas ich kalibracji, przedstawiono na fot. 6. Wykorzystywane są do badania wzajemnego oddziaływania prądów upływających z instalacji zasilającej trakcję metra a także sieci tramwajowej w Warszawie oraz ich wpływu na podziemną stalową infrastrukturę komunalną (rurociągi stalowe).