Rola cynku w ochronie przeciwkorozyjnej stali – przegląd zastosowań
Metaliczny cynk, w różnych postaciach, jest nadal masowo i z doskonałymi rezultatami wykorzystywany w wielu technikach ochrony przed korozją konstrukcji a także wyrobów stalowych eksploatowanych w różnych warunkach – w atmosferze, wodzie i ziemi. Niniejsze opracowanie ma na celu wskazanie różnych sposobów wykorzystania właściwości tego metalu zarówno w uzyskiwaniu efektów barierowych w powłokach, jak i polaryzacji elektrochemicznej w systemach ochrony katodowej.
Cynk (Zn) został odkryty w 1746 r. Jest metalem dość ciężkim o gęstości 7,14 g/cm3, o barwie srebrzystej z niebieskawym odcieniem. Odcień ten jednak w wilgotnym powietrzu szybko zanika wskutek powierzchniowego utlenienia. Jest średnio twardy a także ciągliwy. Temperatura topnienia wynosi 419,5°C. Reaguje chemicznie z kwasami nieutleniającymi i utleniającymi, a także mocnymi zasadami. Związki chemiczne cynku, np. produkty utlenienia, są białe. Cynk jest dobrym przewodnikiem prądu elektrycznego a także diamagnetykiem. W zwykłej temperaturze jest kruchy. W 100-150°C staje się kowalny i ciągliwy, zaś powyżej 200°C kruchość powraca, tak że można go sproszkować.
Cynk należy do metali nieszlachetnych. Jego potencjał normalny względem elektrody wodorowej wynosi 0,76 V. Cynk reaguje z rozcieńczonymi kwasami z wydzieleniem wodoru. Reakcja ta praktycznie nie zachodzi lub przebiega bardzo wolno w przypadku użycia metalu szczególnie czystego. Przyczyną tego jest dość znaczne nadnapięcie, jakie wykazuje wodór, wydzielając się na powierzchni cynku, które można znacznie przyśpieszyć przez dodanie do kwasu niewielkich ilości soli metalu szlachetniejszego niż cynk (np. miedzi).
Cynk a korozja
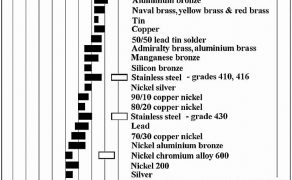
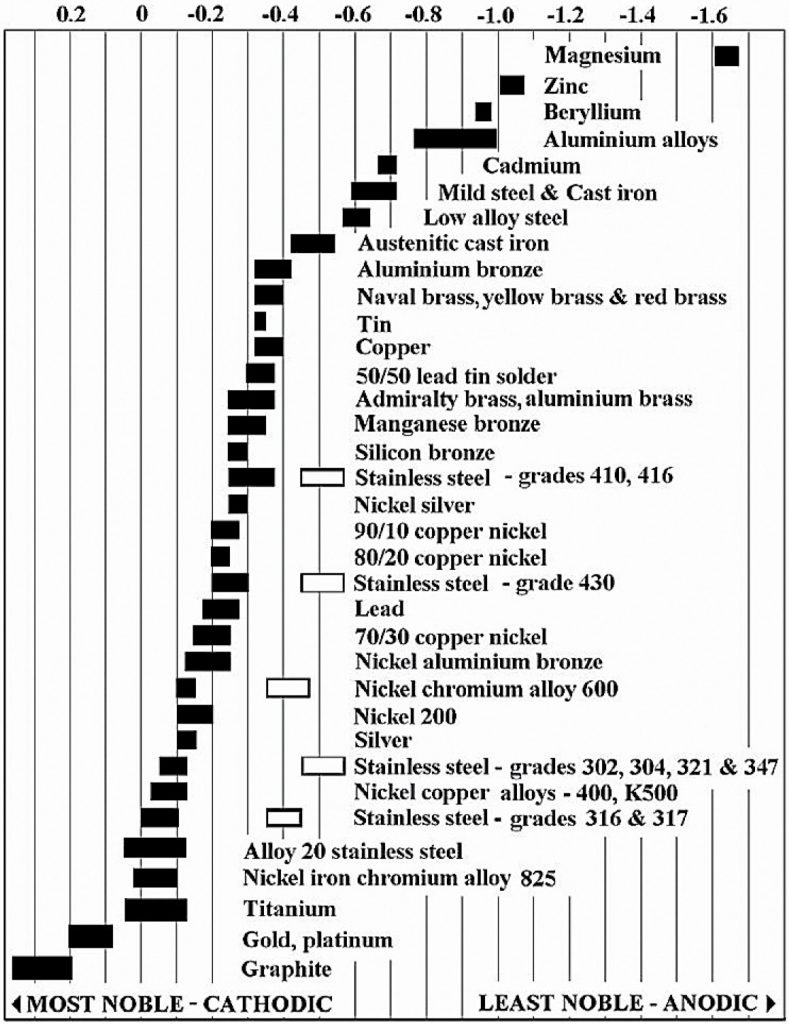
W szeregu napięciowym metali cynk zajmuje jedną z najwyższych pozycji, ustępując jedynie magnezowi. Oznacza to, że w kontakcie z innymi metalami (stopami) w środowisku elektrolitycznym (np. wodzie) cynk będzie anodą. Będzie ulegał przyspieszonemu procesowi korozji, jednocześnie zmniejszając też szybkość utleniania (korozji) metalu znajdującego się z nim w kontakcie. Na rys. 1 przedstawiono opracowany a także upowszechniony przez firmę produkującą jachty L-36.com [1] szereg napięciowy metali/stopów powszechnie stosowanych w technice. Uwzględniono w nim szereg typowych stopów metali konstrukcyjnych.

Reakcja cynk – woda
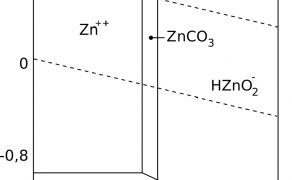
Chcąc zilustrować zachowanie się metalicznego cynku w kontakcie z wodą o różnym pH (w zakresie środowisk od kwaśnego do alkalicznego), niezbędne jest posłużenie się tzw. diagramem Pourbaix. Ilustruje on występujące produkty reakcji metalu z wodą, w zależności od potencjału E i pH środowiska. Na diagramie zaznaczone są obszar termodynamicznej trwałości wody, a także obszary występowania cynku w formie metalicznej oraz związków chemicznych reakcji metalu z wodą. Taki diagram dla cynku przedstawia rys. 2.
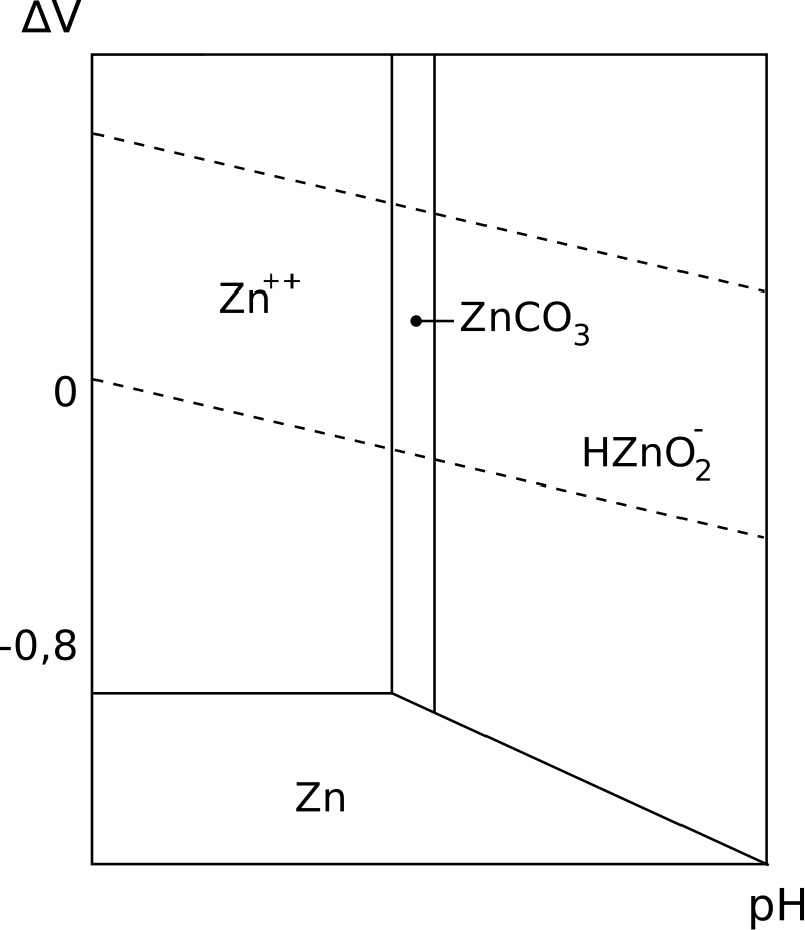

Poniżej obszaru termodynamicznej trwałości wody wydziela się z wody wodór, powyżej – tlen. Z diagramu wynika, że metaliczny cynk w normalnych warunkach w kontakcie z wodą w warunkach atmosferycznych pokrywa się warstewką węglanu cynku. Na wyrobach cynkowych tworzą się więc białe produkty korozji cynku. W niektórych kręgach, np. chłodnictwie, nazywane są „białą rdzą”.
Zastosowanie cynku
Z wieloma metalami cynk tworzy też stopy. Spośród nich największe znaczenie mają stopy z miedzią (mosiądze i tombaki) jak również z miedzią i niklem. Duże znaczenie techniczne do celów ochrony przeciwkorozyjnej ma stop cynku z 25% aluminium, z którego wytwarza się np. powłoki cynkowe.
Największe ilości cynku przerabiane są jednak na blachę cynkową, służącą do krycia dachów, do wyrobu rynien deszczowych, wanien, wiader itp. Do podobnych celów używa się też blachy stalowej pokrytej cynkiem dla ochrony przed korozją. W ostatnich latach, wskutek upowszechnienia norm europejskich dotyczących wymagań stosowania systemów ochrony elektrochemicznej przed korozją, wzrasta także zainteresowanie wykorzystaniem do tego celu anod (protektorów) cynkowych.
Cynk jako powłoka przeciwkorozyjna na stali
Możliwość pokrywania przedmiotów stalowych cynkiem w celu uzyskania zwiększonej odporności wyrobu na korozję stali zaowocowała opracowaniem szeregu technologii przemysłowych tworzenia takich powłok w procesie ogólnie nazywanym cynkowaniem. Powłoka cynkowa w normalnych warunkach atmosferycznych jest znacznie bardziej odporna na korozję niż stal węglowa. Jeżeli jest bezpośrednio narażona na oddziaływanie warunków atmosferycznych, pokrywa się cienką warstwą produktów korozji cynku na swojej powierzchni. W skrajnych przypadkach – białymi osadami, które – dopóki są szczelne – spowalniają dalszy proces korozji cynku.
W przypadku przerwania szczelności powłoki cynkowej będzie ona w dalszym ciągu chronić stal przed korozją. Utworzy się bowiem ogniwo galwaniczne stal-cynk, w którym katodą będzie stal, a anodą bardziej elektroujemny cynk. W rezultacie, pomimo utraty ciągłości warstwy cynku, w miejscach tych zahamowany zostanie proces korozyjny stali. Warunkiem koniecznym, aby tak się stało, jest oczywiście obecność środowiska elektrolitycznego – wody. Dlatego też opisany mechanizm ochrony przed korozją stali uzyskiwany za pomocą powłok cynkowych najlepiej zdaje egzamin dla wyrobów eksploatowanych w wilgotnym środowisku atmosferycznym lub w zanurzeniu w wodzie.
Efekt barierowy
Reasumując, powłoka cynkowa na stali, oddzielając powierzchnie zabezpieczanej stali od agresywnego otoczenia, wywołuje efekt barierowy. Oddziela stal od środowiska korozyjnego, a w przypadku jego utraty (pojawienia się nieszczelności w powłoce) tworzy z podłożem ogniwo galwaniczne. Dzięki temu hamuje lub całkowicie eliminuje procesy korozyjne stali.